机构名称:
¥ 1.0
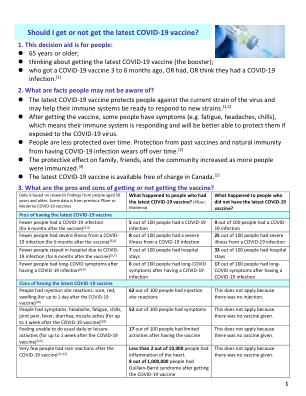
该药品需接受额外监控。这使得能够快速识别新的安全见解。要求医疗保健专业人员报告任何疑似不良反应。有关报告副作用的信息,请参阅第 4.8 节。1.药品名称 Vaxzevria TM 注射用混悬液 COVID-19 疫苗 (ChAdOx1-S [重组]) 2.定性和定量组成 多剂量小瓶,含有 10 剂 0.5 毫升(见第 6.5 节)。一剂(0.5 毫升)包含:编码 SARS-CoV-2 刺突糖蛋白的黑猩猩腺病毒(ChAdOx1-S)*(COVID-19 疫苗 (ChAdOx1-S [重组])),不少于 2.5 x 108 感染单位 (IU) * 在转基因人胚胎肾 293 (HEK) 细胞中并通过重组 DNA 技术生产。本产品含有转基因生物(GMO)。已知效果的赋形剂 每剂(0.5 毫升)约含 2 毫克乙醇。有关辅料的完整列表,请参阅第 6.1 节。3.药物形式 注射用混悬液(注射剂)。悬浮液呈无色至微褐色,清澈至微浑浊,pH 值为 6.6。4.临床特点 4.1 使用指征 Vaxzevria 适用于 18 岁及以上人群的主动免疫,以预防由 SARS-CoV-2 病毒引起的 COVID-19 疾病。疫苗应按照官方建议使用。4.2 剂量和给药方法 剂量 18 岁及以上人士 Vaxzevria 的主要疫苗接种系列包括两剂,每剂 0.5 毫升。第二剂应在第一剂接种后 4 至 12 周(28 至 84 天)内接种(见第 5.1 节)。
Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])
![Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])PDF文件第1页](/bimg/1/111588e9e12502c5a01b02d413656be060835f77.webp)
![Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])PDF文件第2页](/bimg/0/01cb3303c2c8e30e1e88f28a5589f09b603f4288.webp)
![Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])PDF文件第3页](/bimg/5/5483128e411bcb31d5d1523d2dce80fd01df29f8.webp)
![Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])PDF文件第4页](/bimg/6/602baa59c88e066599d3ed99869042c4f688c413.webp)
![Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])PDF文件第5页](/bimg/d/d2a41e0669444ff6cb933c094fd2f012da82c765.webp)

![Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])](/simg/9/9d0067aa95463dbc4fb72aa749159135a3a08a44.png)
![Vaxzevria,COVID-19 疫苗 (ChAdOx1-S [重组])](/simg/7/781b1311d6bbace6cccf0df27edcd48f6790bb59.png)